
 |
Chemie in Rheinland-Pfalz ZUM
Internet |
Autor :
Oleg Warkentin
Geschichte von Paracetamol
Die erste Beobachtungen über
das schmerzlindernde Mittel und Fiebermittel von Paracetamol waren
in dem späten neunzehnten Jahrhundert gemacht, als man nach alternativen
Verbindungen gesucht hatte ,um das Fieber in der Behandlung von Ansteckungen
zu senken. Häufig verwendete Fiebermittel dieser Zeit stellte man
aus natürlichen Stoffen her, wie z.B. die
Rinde des Chinabaums, aus welchem das Wort Chinin abgeleitet ist .
Zwei Alternativen, die entwickelt wurden, Acetanilid(
1886) und Phenacetin
(1887) , hatten Vorteil im Nutzen
gegenüber Chinin, und sie warenFiebermittel
und schmerzlinderndes Mittel zugleich. 1893
wurde eine neue Verbindung hergestellt, die auch eine prompteschmerzlindernde
und fiebersenkende Wirkung hatte - Paracetamol.
Nach genaueren Untersuchungen (1895) ergab sich , dass das Paracetamol
im Harn von Patienten vorhanden war , die Phenacetin
genommen hatten.
1948 stellten
Brodie
und Axelrod fest, dass das Paracetamol
der bedeutendste Metabolit von Phenacetin und Acetanilid ist. Einige Jahre
später, wurde bewiesen, dass Phenacetin beide Wirkungen insich
vereinte und dass die Entstehung von Paracetamol nicht wesentlich
für seine pharmakologischeWirkung war.
Weil ein besonders großer
Anteil von Phenacetin während des ersten Durchgangs
durch die Leber zu Paracetamol umgewandelt wird, zeigt
Phenacetin nur bei hohen Dosierungen direkten schmerzlindernden
Effekt. Die Arbeit von Brodle und
Axelrod führte zu der Einführung von 500 Milligramm Tabletten
von Paracetamol.
Paracetamol
wurde zuerst durch Morse (1878) mittels
Reduktion von p-Nitrophenol mit Zinn in
Eisessig synthetisiert. Das p-Aminophenol wurde durch die Reduktionswirkung
des Zinns hergestellt, welches dann durch Essigsäure acetyliert
wurde. Vignolo
vereinfachte
die Synthese durch die Verwendung von p-Aminophenol als Edikt, welches
er mit Essigsäure acetylierte.
Friedlander
verbesserte schließlich diese Synthese durch Acetylieren des p-Aminophenol
(aus p-Nitrophenol) mit Essigsäureanhydrid an Stelle von Essigsäure.
Chemische Zusammensetzung
Paracetamol, C8H9NO2, wird als N-acetyl-paraaminophenol
oder N-Acetyl-4-aminophenol bezeichnet. Es ist ein weisses Pulver, das
bei 168 °C schmilzt, sich in Wasser nur wenig löst und einen
bitteren Geschmack hat. Es wird als Schmerzmittel eingesetzt.


Herstellung von Acetanilid
Man fügt zu 1 ml Anilin tropfenweise
Acetylchlorid. (Vorsicht !!!) Unter
lebhaftem Zischen soll
eine heftige Reaktion eintreten.
(Reagenzglas
in ein Stativ Einspannen !) Die heftige Reaktion
hört auf,
wenn etwa die gleiche Menge Acetylchlorid
hingefügt ist. Dann gibt man etwa 5 ml dest. Wasser
unter Kühlen hinzu. Es scheidet
sich Acetanilid ab. Der Niederschlag wird abfiltrriert und in wenig
heissem Wasser zur Umkristallisation
gelöst.
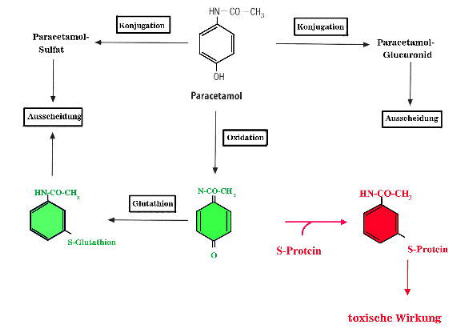
Paracetamol ist ein Acetanilid, das als mildes Analgetikum wirkt. Der grösste Teil dieser Verbindung wird nach Glucuronidierung bzw. Sulfatierung wasserlöslich und damit ausscheidungsfähig. Ein Teil des Paracetamols wird jedoch oxidiert, so dass das in Abbildung dargestellte Zwischenprodukt, eine sehr giftige Verbindung, entsteht. Dieses wird als Glutathion-s-Konjugat ausgeschieden. Es kommt jedoch gelegentlich zu Zuständen, bei denen durch konkurrierende Reaktionen die für diese Reaktion benötigte Glutathionmege nicht zur Verfügung steht. In diesem Fall reagiert das Produkt mit SH-Gruppen auf Hepatocytenproteinen, die damit inaktiviert werden.
Glutathion = Tripeptid bestehend aus Glu-Cys-Gly

Unerwünschte Wirkungen, Vergiftung
Bei Anwendung höher Dosen von
Paracetamol wird die Kapazität der Leber zur Konjugation überschritten
und der vermehrt anfallende Metabolit N-Acetyl-benzochinonimin bindet an
Proteine der Leberzelle; es kommt zu Leberzellnekrosen.
Beim gesunden Erwachsenen liegt die toxische
Dosis bei l0
-15 mg/l, die toxische
Plasmakonzentration bei >200 mg/l. Bei Patienten
mit Leberfunktionsstörungen ist die toxische Dosis geringer
(z. B. nach chronischem Alkoholmissbrauch). Für Kinder wird die tödliche
Dosis je nach Alter mit 2 - 8 g angenommen, für Säuglinge mit
0,5 g. Als Antidot können bei frühzeitiger Gabe
SH-Gruppendonatoren wie N-Acetylcystein lebensrettend sein. Bei Patienten
mit einem genetisch bedingten Mangel an Glucose-6-phosphat-Dehydrogenase
(Favismus) kann es Aufgrund der verringerten Bereitstellung von Glutathion
nach Paracetamolgabe zur verstärkten Methämoglobinbildung kommen.
Bei längerer regelmässiger Zufuhr hoher Dosen des Vorläufers
von Paracetamol, des Phenacetins, wurden häufig interstitielle Nephritiden
mit Papillarnekrosen beobachtet. Inwieweit auch Paracetamol bei langfristiger
Anwendung speziell als Bestandteil von Kombinationspräpapaten
nephrotoxisch ist, wird zur Zeit kontrovers diskutiert.
Übersicht neue ZUM-Datenbank: Relevante Links zur Chemie.
letzte Änderung 19.1O.1998