
 |
Chemie in Rheinland-Pfalz ZUM
Internet |
Autoren : Eugenia Hein und Roland Weckfort
Der Name Aspirin (a + spiraed) leitet sich von
der Pflanze Wiesenspierstaude (spiraed ulmaria) ab. Er wurde von der Firma
Bayer als Markenname für den Wirkstoff Acetylsalicylsäure (Abk.:
ASS)eingeführt. Acetylsalicylsäure ist ein Abkömmling der
Salicylsäure und wurde um 1850
von dem französischen Chemiker Charles
Frederick Gerhardt erstmals hergestellt.
Es war klar, dass auch diese Substanz schmerzstillende
Eigenschaften hat. Doch war das Einnehmen sehr unangenehm, denn sie verätzte
Mund- und Magenschleimhäute. Erst später stellte sich heraus,
dass diese unangenehmen Begleiterscheinungen auf Verunreinigungen zurückzuführen
waren. Im Jahre 1893
fanden Felix Hoffmann und Heinrich Dreser
einen Weg Acetylsalicylsäure zu reinigen. Sie erhielten die Substanz
in Form eines weißen Pulvers. Ihre Mühe wurde überaus reichlich
belohnt: Aspirin wurde zu einem der erfolgreichsten Medikamente in der
Geschichte der Pharmazie.
Doch Aspirin hat auch seine Nachteile. Empfindliche
Menschen reagieren darauf mit Reizungen und selten auch mit Blutungen von
Magen- und Darmschleimhaut.
Im Laufe seiner hundertjährigen Geschichte
wurde Acetylsalicylsäure zeitweise als das Standardmittel gegen Infektionskrankheiten
(Fieber, Husten, grippale Infekte) und Arthritis (der altbekannte Rheumatismus)
verordnet. Allerdings heilt es keine dieser Krankheiten, es macht sie nur
erträglicher, indem es die Schmerzen lindert.
Neben Acetylsalicylsäure enthalten
Aspirintabletten auch Zitronensäure und Natriumhydrogencarbonat, welches
mit der Acetylsalicylsäure zu deren Natriumsalz reagiert, das wesentlich
besser wasserlöslich und etwas schneller wirksam ist als die
reine Säure. Es reagiert ebenfalls mit Zitronensäure, wobei Kohlendioxid
entsteht, das in Form vieler kleiner Gasblasen entweicht. Doch egal, ob
man nun die reine Acetylsalicylsäure oder eines ihrer Salze zu sich
nimmt:der Unterschied in der Wirksamkeit ist nicht besonders groß.
Das liegt daran, dass im Magen ein saures Millieu herrscht, worin das Salz
rasch wieder in die Säure zurückverwandelt wird. Da die Säure
schlecht wasserlöslich ist, fällt sie wieder als Feststoff aus,
wenn auch in sehr kleinen Kristallen. Diese kleinen Kristalle reizen die
Magenschleimhaut nicht so sehr wie die großen Kristalle, die man
in Form der reinen Säure zu sich nehmen würde. Insofern ist das
Natriumsalz
also verträglicher.
Auch wenn Aspirin seit hundert Jahren in Gebrauch
ist, birgt es doch noch Risiken. Eine nicht alzu häufige Nebenwirkung
sind die bereits erwähnten Blutungen der Magenschleimhaut. Für
Kinder kann die Behandlung von Windpocken oder grippalen Infekten mit Acetylsalicylsäure
tödliche Folgen haben.
Trotz seiner Nebenwirkungen ist Acetylsalicylsäure
ein bemerkenswerter Wirkstoff und ein Schmerzmittel. Ihm wird nachgesagt,
Herzinfarkte und Thrombosen abwehren zu können, und es wurde sogar
gemutmaßt, dass es sich bei der Behandlung von Krebs, grauem Star
und Senilität einsetzen lasse.
Acetylsalicylsäure verhindert, dass der
Körper diejenigen Stoffe produziert, die das Verklumpen der roten
Blutkörperchen bewirken; verhindert die Bildung von Thrombosen und
verbessert die vorbeugende Wirkung gegen Senilität, indem das Gehirn
besser mit Sauerstoff versorgt wird. Die Wirksamkeit gegen grauen Star
schließlich beruht darauf, dass Acetylsalicylsäure diejenigen
Protein-Moleküle zerstört, welche den Augapfel trübe machen.
Die Höchstmenge pro Tag soll 4g nicht übersteigen.
Eine Einzeldosis von 10g ist lebensbedrohlich, weil dann das Blut zu sauer
wird. Es führt zur Beschleunigung der Atmung, Ankurbelung der Nierenaktivität,
was einen gefährlichen Flüssigkeitsverlust zur Folge haben kann.
Dann kommt es zur Gewebszerstörung und letzten Endes zum Tod.
Wirkungsweise:
Aspirin hemmt ein Enzym, das die Produktion von
Prostaglandinen steuert. Die Prostaglandine sind eine Gruppe von chemischen
Verbindungen, welche eine Reihe biologischer Funktionen regulieren: Verdauung,
Nierenfunktion, Blutkreislauf. Bestimmte Prostaglandine
lösen außerdem Schmerzsignale
aus. Diese werden bei Verletzungen und Krankheiten
freigesetzt, und deshalb spüren wir Entzündungen, Schmerz und
Fieber. Aspirin verhindert die Synthese von
Prostaglandinen in geschädigtem Gewebe.
Herstellung von Acetylsalicylsäure:
5g Salicylsäure werden mit etwa 5ml Essigsäureanhydrid
in einem Erlenmeyerkolben mit 1Tropfen konz. H2SO4
versetzt und umgeschüttelt. Man erhitzt den Erlenmeyerkolben im Wasserbad
ca.15Min. auf ca. 60°C unter Umrühren. Dann erhöht man nochmal
etwa 5Min. die Flüssigkeit auf 80°-90°C unter weiterem Umrühren.
Schließlich nimmt man den Erlenmeyerkolben aus dem Wasserbad und
stellt ihn in Eiswasser, so fällt sehr schnell Acetylsalicylsäure
aus, die nun mit einer Nutsche abgesaugt werden kann. Der Rückstand
wird mit Eiswasser ausgewaschen.
Allgemeine Reaktionsgleichung..


Ausführliche Synthesevorschläge siehe
Anhang.
Schmelzpunktbestimmung des Präparats:
Man füllt etwas von der Substanz in eine
Kapillare und bringt sie in den seitlichen Ansatz des Schmelzpunktbestimmungsapparats
(oder Zweihalskolben). Gut macht sich hier auch ein probengefülltes
Mikroreagenglas, was in den seitlichen Hals passt. Zur Sicherheit sollte
man das Reagenzglas mit einer Apparaturklemme sichern.
Der Schmelzpunkt unseres Roh-ASS wurde mit etwas
unter 136°C bestimmt (Literaturwert 136°C).

Reinigung der erhaltenen Substanz:
1) Man überträgt die synthetisierte
ASS in ein großes sauberes Reagenzglas.
2) Kristallisiert das Produkt um, indem man 1ml
Ethanol und 8ml entionisiertes Wassers
hinzufügt. Dann wird
die Substanz im heißen Wasserbad erhitzt, um sie wieder aufzulösen
und
nachher in Eiswasser abzukühlen.
3) Man filtriert das Produkt mit einer Nutsche
ab.
4) Die Kristalle werden in einem Trockenofen
bei 110°C 1Stunde lang getrocknet oder bei
Zimmertemperatur den ganzen
Tag.
Dann bestimmt man erneut den Schmelzpunkt. Die
erhaltenen Werte lagen jetzt noch näher bei 136°C. Damit weiß
man aber noch nicht, ob das Produkt verwendbar ist.
Untersuchung der hergestellten ASS
auf Reinheit:
1) Man löst eine Aspirintablette in dest.
Wasser und bestimmt den pH-Wert mit Universalindikator-
papier.
2) Eine 1/2 Spatelspitze der hergestellten Acetylsalicylsäure
wird in etwas dest. Wasser gelöst und
mit Universalindikator der
pH-Wert geprüft.
3) Man gibt zu der ASS-Lösung einige
Tropfen Eisen-(III)-chlorid-lösung (w = 1%) und etwas Ethanol.
Es tritt eine schwache violette
Färbung auf => Nachweis für den Rest freie Salicylsäure,
der nicht reagiert hat.
4) Zum Vergleich werden beide Versuche mit Phenol
ausgeführt. Der pH-Wert des Phenols ist nur
schwach sauer, die Umsetzung
mit Eisen-(III)-chlorid-lösung ohne Ethanol zeigt, dass die Farb-
reaktion die gleiche wie bei
der Salicylsäure ist, nämlich kräftig violett (Es
bilden sich hier Farbkomplexe zwischen Fe (III)
und den OH Gruppen der aromatischen
Verbindungen).
Literatur / Quellen:
Zwei Synthesemechanismen zur Acetylsalicylsäure
1. Reaktionsmechanismus
Bild 1: H+
vom Katalysator greift Essigsäureanhydrid am Sauerstoff an. Dabei
entsteht ein elektrophiles Teilchen.
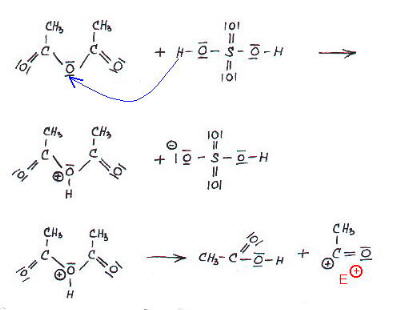
Bild 2: Durch Acylierung
von Salicylsäure erhalten wir Acetylsalicylsäure. Rückbildung
des Katalysator.
Elektrophile Substitution
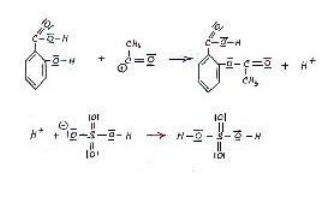
Der 2. Reaktionsmechanismus
Bild 3: H+
des
Katalysators greift an der OH Gruppe der Salicylsäure an.

Bild 4: Angriff des
nukleophilen Teilchens an die positivierte Stelle des Benzolrings.
Nukleophile
Substitution
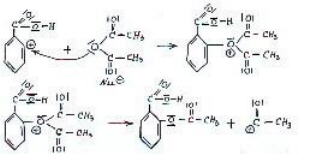
Bild 5: Das Carbeniumion reagiert mit Wasser. Der Katalysator wird zurückgebildet. Entstehung von Essigsäure.

Übersicht neue ZUM-Datenbank: Relevante Links zur Chemie.
letzte Änderung 19.1O.1998